– 與Crizotinib相比,ALUNBRIG的疾病進展或死亡風險較低,腦轉移患者中低76%,所有患者中低57% –
– ALUNBRIG的中位無進展生存期比Crizotinib長3倍 –
麻塞諸塞州劍橋和日本大阪--(美國商業資訊)--武田藥品工業株式會社(TSE:4502/NYSE:TAK)今天發表了3期ALTA-1L試驗的更新資料,該試驗評估ALUNBRIG vs crizotinib用於既往未用過ALK抑制劑的間變性淋巴瘤激酶陽性(ALK+)晚期非小細胞肺癌(NSCLC)患者。2年多後的隨訪結果顯示,入組時腦轉移的新診斷患者中,ALUNBRIG研究者的評定疾病進展或死亡降幅達76%(風險比[HR] = 0.24, 95% CI: 0.12–0.45)。結果同時顯示,在所有患者中,ALUNBRIG的疾病進展或死亡降幅達57% (HR = 0.43, 95% CI: 0.31–0.61)。上述資料將在11月23日週六新加坡召開的2019年歐洲腫瘤內科學會(ESMO)亞洲大會的會長場次上呈報。
此新聞稿包含多媒體內容。完整新聞稿可在以下網址查閱:https://www.businesswire.com/news/home/20191122005494/en/
ALTA-1L試驗結果由兩家獨立的評審機構進行評定——研究者和一個持盲的獨立評審委員會(BIRC)——並報告雙方的評定結果。第二次中期分析資料截止時(2019年6月28日),主要終點BIRC評定的無進展生存(PFS)的HR為0.49 (95% CI: 0.35–0.68, log-rank P<0.0001),表明疾病進展或死亡風險降幅達51%。
ALTA-1L主要研究者、科羅拉多大學癌症中心Joyce Zeff肺癌研究主任D. Ross Camidge, M.D., Ph.D.表示:「該病錯綜複雜且該群體預期壽命長,有鑑於此,最重要的是醫生擁有多手耐受良好且療效持久的治療備選,才能滿足患者的需求。透過ALTA-1L試驗為期25個月的隨訪,brigatinib不斷展示出總體和顱內療效,同時生活品質大幅優於crizotinib,鞏固了其作為ALK+ NSCLC一線治療的潛力。」
長期分析的追加資料顯示,新診斷患者無論基線時有無腦轉移,均能受惠於ALUNBRIG治療,腦轉移是首次進展最常見的部位之一,可導致生活品質低下。
武田腫瘤治療領域部主管Phil Rowlands表示:「武田致力於透過開發產品來推動肺癌治療領域的發展並因應患者未獲滿足的需求。我們對迄今為止的進展感到自豪,包括ALTA-1L試驗的上述更新結果,該結果顯示,ALUNBRIG延遲疾病進展達2年以上,並大幅降低基線腦轉移患者的疾病進展風險。我們期待著向全球主管機關遞交上述資料,從而使全世界的ALK+ NSCLC患者都能獲得ALUNBRIG。」
GO2 肺癌基金會共同創辦人、理事會會長Bonnie Addario表示:「ALK+ NSCLC患者的個體化治療需求是多樣化的,因為癌症並非一種通碼疾病。持續研究和像ALTA-1L這樣的臨床試驗對於我們達成在治療早期改善患者治療結果和生活品質的目標極為重要。我們感謝參與此次臨床試驗的患者、家屬和研究者,該試驗在新診斷ALK+ NSCLC患者中展現了有臨床意義的結果。」
ALUNBRIG在ALTA-1L試驗中的安全性與現有美國版處方資訊大體一致。
關於ALTA-1L試驗
成人應用ALUNBRIG的3期ALTA-1L(ALK in Lung Cancer Trial of BrigAtinib in 1st Line,BrigAtinib一線治療肺癌試驗中的ALK)試驗是一項正在進行的全球多中心、開放、隨機對照試驗,入組275例既往未用過ALK抑制劑的間變性淋巴瘤激酶陽性(ALK+)局部晚期或轉移性非小細胞肺癌(NSCLC)患者(ALUNBRIG,n=137例,crizotinib,n=138例)。患者接受ALUNBRIG 180毫克每日一次(7天導入期90毫克每日一次)或crizotinib 250毫克每日2次。
ALUNBRIG組的中位年齡是58歲,crizotinib組是60歲。基線時腦轉移的患者,ALUNBRIG組為29%,crizotinib組為30%。因晚期或轉移疾病既往接受過化療的患者,ALUNBRIG組為26%,crizotinib組為27%。
主要終點是持盲的獨立評審委員會(BIRC)評定的無進展生存率(PFS)。次要終點包括客觀緩解率(ORR)(根據RECIST v1.1)、顱內ORR、顱內PFS、總生存(OS)、安全性和耐受性。
關於ALUNBRIG® (brigatinib)
ALUNBRIG是下一代強效選擇性酪氨酸激酶抑制劑(TKI),旨在靶向作用於並抑制非小細胞肺癌(NSCLC)的間變性淋巴瘤激酶(ALK)融合蛋白。2017年4月,ALUNBRIG獲得美國食品藥品管理局(FDA)的加速核准,用於crizotinib用藥期間進展或無法耐受的間變性淋巴瘤激酶陽性(ALK+)轉移性NSCLC患者。該適應症獲得加速核准的依據是腫瘤緩解率和緩解持續時間。該適應症的持續核准有待一項證實性試驗對臨床效益進行驗證和描述。
ALUNBRIG目前已在40多個國家獲准,用於治療crizotinib用藥期間病情惡化或無法耐受crizotinib的ALK+轉移性NSCLC患者,包括美國、加拿大和歐盟。
ALUNBRIG已獲得FDA突破性藥物認證,用於治療crizotinib抗藥的ALK+ NSCLC患者,該藥還獲得FDA孤兒藥認證,用於治療ALK+ NSCLC、ROS1+和EGFR+ NSCLC。
武田在肺癌領域
武田致力於拓展在ALK+ NSCLC和EGFR外顯子20治療領域的經驗。我們的全方位專案包括下列臨床試驗,旨在不斷因應肺癌患者未獲滿足的需求:
ALUNBRIG
TAK-788
欲瞭解有關ALUNBRIG和TAK-788臨床試驗的進一步資訊,請造訪www.clinicaltrials.gov。
關於ALK+ NSCLC
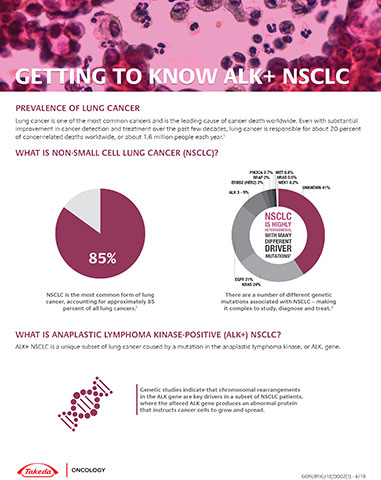
非小細胞肺癌(NSCLC)是最常見的肺癌類型,據世界衛生組織資料,其占全球每年約180萬例新診斷肺癌病例的約85% 1,2。基因研究顯示,在一部分NSCLC患者中,間變性淋巴瘤激酶(ALK)的染色體重組是關鍵的驅動因素3。約3~5%的轉移性NSCLC患者有ALK基因重排4,5,6。
武田承諾在NSCLC領域不斷研發,以改善患者的生活,全球每年約有4萬例患者被診斷為這一嚴重而罕見類型的肺癌7。
ALUNBRIG重要安全性資訊
警示與注意事項
間質性肺病(ILD)/肺間質炎:ALUNBRIG可引起與間質性肺病(ILD)/肺間質炎吻合的重度、威脅生命及致命性的肺不良反應。ALTA (ALTA)試驗中,ILD/肺間質炎的發生率,90毫克組(9毫克每日一次)為3.7%,90→180毫克組(180毫克每日一次,7天導入期為90毫克每日一次)為9.1%。6.4%的患者早期(啟用ALUNBRIG後的9天內;中位發病在2天內)出現與ILD/肺間質炎吻合的不良反應,2.7%出現3至4度反應。應監測呼吸系統症狀(例如呼吸困難、咳嗽等)的新發或惡化,尤其是在啟用ALUNBRIG的最初1周期間。患者一旦有呼吸系統症狀的新發或惡化,應暫停ALUNBRIG,並立即評估ILD/肺間質炎或呼吸系統症狀的其他病因(例如肺栓塞、腫瘤進展和感染性肺炎)。對於1或2度ILD/肺間質炎,在恢復至基線後,可減量重啟ALUNBRIG或永久停用ALUNBRIG。對於3或4度ILD/肺間質炎,或是1或2度ILD/肺間質炎復發,應永久停用ALUNBRIG。
高血壓:ALTA試驗中,高血壓的報告率,ALUNBRIG 90毫克組為11%,90→180毫克組為21%。總體而言,5.9%的患者出現Grade 3高血壓。在ALUNBRIG治療前應控制血壓。ALUNBRIG治療2周後應監測血壓,之後至少每月一次。對於Grade 3度高血壓,即便服用最佳降壓治療藥物,也應暫停ALUNBRIG。高血壓緩解後,或嚴重程度改善至Grade 1,可減量重啟ALUNBRIG。對於Grade 4高血壓或Grade 3高血壓復發,可考慮永久停用ALUNBRIG治療。ALUNBRIG與引起心搏過緩的降壓藥合併使用應慎重。
心搏過緩:ALUNBRIG可引起心搏過緩。ALTA試驗中,心率低於每分鐘50跳(bpm)者,90毫克組為5.7%,90→180毫克組為7.6%。90毫克組有1例(0.9%)患者出現2度心搏過緩。ALUNBRIG治療期間應監測心率和血壓。若無法避免合併已知能引起心搏過緩的藥物,則應加大監測頻率。對於症狀性心搏過緩,應暫停ALUNBRIG,並核查是否有合併已知能引起心搏過緩的藥物。若發現有合併已知能引起心搏過緩的藥物,且已停用或調整劑量,可在心搏過緩緩解後,依原先劑量重啟ALUNBRIG;否則,應在症狀性心搏過緩緩解後,減低ALUNBRIG劑量。對於威脅生命的心搏過緩,若未發現有致病的合併用藥,應停用ALUNBRIG。
視覺障礙:ALTA試驗中,引起視覺障礙的不良反應(包括視物模糊、複視和視敏度減低)報告率,ALUNBRIG 90毫克治療組為7.3%,90→180毫克組為10%。3度黃斑部水腫和白內障在90→180毫克組各出現1例。應告知患者報告任何視覺症狀。若患者有2度或以上視覺症狀新發或惡化,應暫停ALUNBRIG,並進行眼科評估。若2或3度視覺障礙恢復至1度或基線嚴重程度,可減量重啟ALUNBRIG。對於4度視覺障礙,應永久停用ALUNBRIG。
肌酸磷酸激酶(CPK)升高:ALTA試驗中,肌酸磷酸激酶(CPK)升高者,ALUNBRIG 90毫克治療組為27%,90→180毫克組為48%。3-4度CPK升高發生率,90毫克組為2.8%,90→180毫克組為12%。因CPK升高而減量者,90毫克組為1.8%,90→180毫克組為4.5%。應告知患者報告任何無法解釋的肌肉疼痛、壓痛或無力。ALUNBRIG治療期間應監測CPK水準。對於3或4度CPK升高,應暫停ALUNBRIG。待緩解或恢復至1度或基線,可依原先劑量或減量重啟ALUNBRIG。
胰腺酶升高:ALTA試驗中,澱粉酶升高者,90毫克組為27%,90→180毫克組為 39%。脂肪酶升高者,90毫克組為21%,90→180毫克組為45%。3或4度澱粉酶升高者,90毫克組為3.7%,90→180毫克組為2.7%。3或4度脂肪酶升高者,90毫克組為4.6%,90→180毫克組為5.5%。ALUNBRIG治療期間應監測脂肪酶和澱粉酶。對於3或4度胰腺酶升高,應暫停ALUNBRIG。待緩解或恢復至1度或基線,可依原先劑量或減量重啟ALUNBRIG。
高血糖:ALTA試驗中,43%接受ALUNBRIG的患者出現高血糖新發或惡化。3.7%的患者發生3度高血糖(根據空腹血糖水準的實驗室評估)。20例基線時有糖尿病或葡萄糖耐受不良的患者中,有2例(10%)在接受ALUNBRIG期間需要啟用胰島素。啟用ALUNBRIG之前應評估空腹血糖,之後應定期監測。必要時啟用或調整降血糖藥。若最佳藥物處治無法充分控制血糖,應暫停ALUNBRIG直至血糖獲得充分控制,也可考慮 ALUNBRIG減量或永久停藥。
胚胎胎兒毒性:依其作用機制和動物研究結果,孕婦服用ALUNBRIG可引起胎兒損害。缺乏ALUNBRIG在孕婦中用藥的臨床資料。應告知孕婦該藥對胎兒的潛在風險。應告知育齡女性在ALUNBRIG治療期間及末次給藥後至少4個月內採取有效的非荷爾蒙避孕。應告知有育齡女性伴侶的男性在治療期間及末次給藥後至少3個月內採取有效的避孕。
不良反應
嚴重不良反應發生率,90毫克組為38%,90→180毫克組為40%。最常見嚴重不良反應為肺炎(總體發生率為5.5%,90毫克組發生率為3.7%,90→180毫克組為7.3%)和ILD/肺間質炎(總體發生率為4.6%,90毫克組發生率為1.8%,90→180毫克組為7.3%)。3.7%的患者發生致命性不良反應,包括肺炎(2例)、猝死、呼吸困難、呼吸衰竭、肺栓塞、細菌性腦膜炎和尿路敗血症(各1例)。
最常見(≥25%)不良反應,90毫克組為噁心(33%)、疲乏(29%)、頭痛(28%)和呼吸困難(27%),90→180毫克組為噁心(40%)、腹瀉(38%)、疲乏(36%)、咳嗽(34%)和頭痛(27%)。
藥物交互作用
CYP3A抑制劑:應避免ALUNBRIG與強效或中效CYP3A抑制劑合用。葡萄柚或葡萄柚汁也可升高brigatinib的血漿濃度,應避免食用。若無法避免與強效或中效CYP3A抑制劑合用,ALUNBRIG應減量。
CYP3A誘導劑:應避免ALUNBRIG與強效或中效CYP3A誘導劑合用。如果無法避免與中效CYP3A誘導劑合用,ALUNBRIG應加量。
CYP3A基質:ALUNBRIG與敏感型CYP3A基質(包括荷爾蒙類避孕藥)合併用藥可引起敏感型CYP3A基質的濃度降低和失效。
特殊人群用藥
孕婦:ALUNBRIG可引起胎兒損害。應告知育齡女性該藥對胎兒的潛在風險。
哺乳期:沒有有關brigatinib對母乳分泌或對母乳餵養嬰兒或母乳產量影響方面的資料。由於對母乳餵養嬰兒存在潛在不良反應,建議哺乳女性在ALUNBRIG治療期間不得授乳。
育齡男女:
妊娠試驗:育齡女性啟用ALUNBRIG之前應驗證妊娠狀態。
避孕:應告知育齡女性在ALUNBRIG治療期間及末次給藥後至少4個月內採取有效的非荷爾蒙避孕。
不孕: ALUNBRIG可引起男性生育力減退。
兒童用藥:ALUNBRIG在兒童患者中的安全性和療效尚未確立。
老年用藥:ALUNBRIG臨床研究未納入足量的65歲及以上患者,以確定他們的緩解是否有別於較年輕的患者。
肝或腎功能損害:輕度或中度肝損或輕度或中度腎臟損害患者不建議調整劑量。重度肝損或重度腎臟損害患者使用ALUNBRIG時應減量。
如需查看ALUNBRIG的美國版完整處方資訊,請造訪www.ALUNBRIG.com。
關於武田藥品工業株式會社
武田藥品工業株式會社(TSE:4502/NYSE:TAK)是一家總部位於日本、以價值為基礎的研發導向型生物製藥業領袖,致力於將科學轉化為高度創新的藥品,從而為患者提供更佳的健康和更美好的未來。武田的研發努力專注於腫瘤學、胃腸病學(GI)、罕見疾病和神經科學。我們還對血漿衍生療法和疫苗進行有針對性的研發投資。我們正致力於開發高度創新的藥物,透過推動新治療方案的尖端,利用我們增強的協作研發引擎和能力,創造強大的、模式多樣化的產品線,為改變人們的生活做出貢獻。我們的員工致力於改善患者的生活品質,與近80個國家和地區的醫療領域合作夥伴攜手合作。
如需詳情,請造訪https://www.takeda.com。
重要提示
就本文而言,「新聞稿」指本文件、任何口頭陳述、任何問答會議,以及武田藥品工業株式會社(「武田」)就本新聞稿相關內容進行討論或散發的任何書面或口頭資料。本新聞稿(包括任何口頭簡報和與此有關的任何問答)並非是也不構成、代表或形成任何出價購買、以及收購、註冊、交換、銷售或處置任何證券的任何要約、邀請或徵集,或在任何司法管轄區徵集任何投票或核准之一部分。不得憑藉本新聞稿公開發售任何股票。除非根據美國《1933年證券法》及其修訂進行登記或由此取得豁免,否則不得在美國配售任何證券。本新聞稿(連同任何可能向接收方提供的進一步資訊)僅用於為接收方提供資訊參考用途(並非用於評估任何投資、收購、處置或任何其他交易)。任何不遵守上述限制的行為可能會違反適用證券法。
武田透過投資直接或間接所持有公司均為獨立的實體。在本新聞稿中,有時出於方便的目的,使用「武田」作為武田及其子公司的統稱。同樣,像「我們」(主語和賓語形式)和「我們的」這類詞彙也是子公司的統稱或代表公司的員工。這些表述也被用於沒有實際意義、不涉及某個特定的公司或某些公司的場合。
前瞻性陳述
本新聞稿及與之相關的所分發的任何資料可能含有與武田未來業務、未來狀況和營運業績有關的前瞻性陳述、看法或意見,包括武田的預估、預測、目標和計畫。前瞻性陳述常常包含但不限於下列措辭,例如「目標」、「計畫」、「認為」、「希望」、「繼續」、「預計」、「旨在」、「打算」、「確保」、「將」、「可能」、「應」、「會」、「或許」、「預期」、「估計」、「預測」或類似表述或其否定形式。本文中的前瞻性陳述僅根據武田截至發布日期的估計和假設。此類前瞻性聲明並非是武田或其管理階層對未來業績所做的任何保證,並涉及已知和未知的風險、不確定性和其他因素,包括但不限於:武田全球業務所面臨的經濟形勢,包括日本和美國的總體經濟環境;競爭壓力和發展情況;適用法律法規的變動;產品開發專案的成功或失敗;監管當局的決策或做出決策的時機;利率和匯率波動;有關已售產品或候選產品安全或功效的索賠或疑問;已收購公司的合併後整合努力的時機和影響;以及能否分割對武田營運非核心的資產和任何此類分割的時機,所有這些都可能會導致武田的實際業績、表現、成就或財務狀況與此類前瞻性陳述所描述或暗指的任何未來業績、表現、成就或財務狀況發生重大偏差。關於以上及可能影響武田結果、業績、成就或財務狀況的其他因素的更多資訊,請參閱武田向美國證券交易委員會提交的Form 20-F最新年報「第3項. 關鍵資訊—D. 風險因素」和其他報告,具體請查閱武田網站https://www.takeda.com/investors/reports/sec-filings/或www.sec.gov。武田的未來結果、業績成就或財務地位可能與前瞻性陳述所言傳或意會的內容有實質性差距。收到這一新聞稿的個人不應對任何前瞻性陳述寄予不適切的依賴。武田沒有義務更新本新聞稿中的任何前瞻性陳述或公司可能發布的任何其他前瞻性陳述,除非是法律或證券交易規則所要求。歷史業績並不能代表未來業績,而且本新聞稿中的武田業績並不能指代,也並非是武田未來業績的預估、預測或推測。
1世界衛生組織。全球癌症資料最新版。 https://www.who.int/cancer/PRGlobocanFinal.pdf. 造訪於2019年5月11日。
2美國癌症學會。What is Non-Small Cell Lung Cancer?(何謂非小細胞肺癌?)https://www.cancer.org/cancer/non-small-cell-lung-cancer/about/what-is-non-small-cell-lung-cancer.html. 造訪於2019年5月11日
3 Kris MG, et al. JAMA, 2014;311:1998-2006.
4 Gainor JF, Varghese AM, Ou SH, et al. Clin Cancer Res. 2013;19(15):4273-81.
5 Koivunen JP, Mermel C, Zejnullahu K, et al. Clin Cancer Res. 2008; 14(13):4275-83.
6 Wong DW, Leung EL, So KK, et al. Cancer. 2009; 115(8):1723-33.
7 Chia PL, Mitchell P, Dobrovic A, John T. Clin Epidemiol, 2014;6:423-432.
原文版本可在businesswire.com上查閱:https://www.businesswire.com/news/home/20191122005494/en/
免責聲明:本公告之原文版本乃官方授權版本。譯文僅供方便瞭解之用,煩請參照原文,原文版本乃唯一具法律效力之版本。
聯絡方式:
武田藥品工業株式會社
日本媒體
Kazumi Kobayashi
kazumi.kobayashi@takeda.com
+81 (0) 3-3278-2095
日本以外媒體
Lauren Padovan
lauren.padovan@takeda.com
+1-617-444-1419
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至 content@finet.com.hk,獲得書面確認及授權後,方可轉載。