再鼎醫藥未來是不是生物科技領域的明星難以解答,但是眼下,由於短期漲幅巨大,明星一詞並不過分。自2020年9月28日於港交所上市交易以來,截至2021年1月21日收盤,再鼎醫藥股價錄得149.83%漲幅。
如此的漲幅或許來源於三個方面:管理層運營策略、與創投機構的聯係、即將商業化的產品。
再鼎通過與GSK、BMS、Paratek、Five Prime、Entasis、Novocure、MacroGenics、Deciphera、Incyte、Regeneron及Turning Point建立合作夥伴關係,在中國、香港、澳門以及(在若幹情況下)中國台灣、澳大利亞、新西蘭及亞太地區其他國家擁有12個活躍的引進授權臨床候選藥物可供開發。
於2015年3月,再鼎與百時美施貴寶簽訂了授權協議,據此再鼎獲獨家授權在中國、香港及澳門開發、制造、使用、出售、進口及商業化brivanib,並附帶獨家權利在若幹條件下將授權區域擴展至包括中國台灣及韓國。根據該協議,再鼎需向百時美施貴寶支付按brivanib銷售淨額計得的里程碑付款及特許權費。
而觀察杜瑩(再鼎創始人)博士的履歷,除了光鮮的藥企研發背景以外,在創辦再鼎醫藥之前,其曾於紅杉資本中國基金任職兩年。此外,啓明創投亦持有再鼎較大的股份。
簡之,上述策略疊加與資本市場密切的聯係,可為後續其餘潛在企業投資機會作為一項評價標準。
以上,便是再鼎醫藥重要的投資背景。
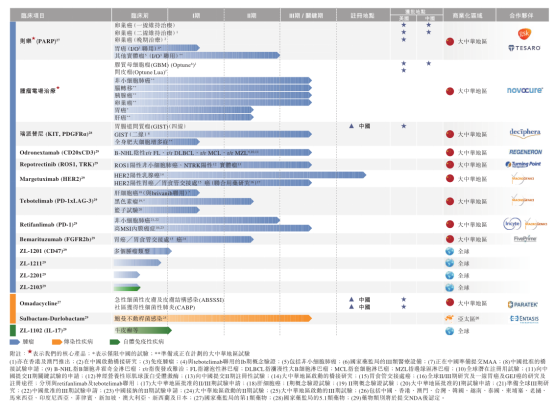
(再鼎醫藥產品佈局 來源:再鼎醫藥)
策略玩的再好,還需要具體的產品作為底層支撐。目前,再鼎的核心看點在於三項產品:則樂、optune(腦腫瘤電場治療)、瑞派替尼。
則樂(尼拉帕利)為每日一次的小分子聚(ADP-核糖)聚合酶1/2或PARP 1/2抑制劑,獲國家藥監局批準成為中國治療多種實體瘤類型的1類藥物。則樂分别於2017年3月獲FDA及於2017年11月獲EMA批準,用作復發性鉑敏感型卵巢癌女性患者的維持治療。該維持治療用於該等先前接受治療但預期癌症會復發的女性患者,旨在避免或減緩先前治療緩解後癌症的復發。鉑敏感型癌症為一種經最初鉑類化療後會緩解及化療後緩解期超過六個月的疾病。
香港衛生署於2018年10月批準則樂,再鼎於2018年12月在香港推出則樂。於2019年6月,則樂獲得上市許可,可於澳門將則樂商業化,用於治療復發性卵巢癌女性患者。中國國家藥品監督管理局(或國家藥監局)於2019年12月批準則樂用於對鉑類化療有完全或部分緩解的復發性上皮性卵巢癌、輸卵管癌或原發性腹膜癌成人患者的維持治療,隨後再鼎於2020年1月於中國推出則樂。
截至2020年8月31日,則樂已在中國一個省及六個城市成功獲納入與中國基本醫療保險計劃互補的區域性報銷計劃。截至2020年8月31日,則樂亦獲列入市政府所指導的17種商業健康保險及12種補充保險。
競爭上,截至2020年7月,中國僅有兩種上市的PARP抑制劑,一種為於2018年獲批來自阿斯利康的利普卓(奧拉帕尼);另一種為於2019年獲批的則樂(尼拉帕利)。
阿斯利康的利普卓於2018年12月獲FDA批準用於一線維持治療,但僅適用於BReast CAncer基因(「BRCA」)陽性患者;其次於2020年5月獲FDA批準用於同源重組缺乏症(HRD)陽性的癌症患者,其佔晚期卵巢癌患者中的50%,但僅可與阿瓦斯汀(貝伐單抗)聯用。相比之下,則樂獲批用於所有晚期卵巢癌患者,而不論其生物標志物狀態,並且可以作為單藥療法。
另外四種PARP抑制劑正在中國進行III期臨床開發或處於NDA階段,包括在中國及全球開發的候選藥物。其中三種PARP抑制劑的主要適應症專注於晚期卵巢癌,而另一種則側重轉移性前列腺癌。在晚期卵巢癌適應症中,其中一種產品僅針對BRCA陽性患者。
Optune(腫瘤電場治療)為一種便攜式電池或電源供電設備,其通過電絕緣表面換能器數組向患者剃光頭發的頭部傳遞低強度(1-3 V/cm)及中頻(100-300 kHz)的交替腫瘤電場治療而產生作用。
腫瘤電場治療為一種癌症療法,即使用調節至特定頻率的電場來阻斷細胞分裂,抑制腫瘤生長並導致受影響癌細胞死亡。Optune已獲FDA根據上市前批準申請(「PMA」)批準與化療藥物TMZ聯用治療新診斷為GBM(膠質母細胞瘤)的成人患者,並批準用於治療在接受化療作為單一療法後確診復發GBM的成人患者。Optune亦獲批準或已獲發CE證書以將Optune在歐盟、日本及若幹其他國家上市用於治療GBM。
於2018年9月,再鼎與Novocure進行全球戰略發展合作,據此,再鼎獲得在中國、香港及澳門開發及商業化Optune(腫瘤電場治療)的獨家授權。於2019年8月,國家藥監局就Optune授予創新醫療器械認定;於2020年5月,國家藥監局批準了Optune的上市許可申請(MAA),且毋須進行與TMZ聯用治療GBM新患者的臨床試驗,且亦可用作治療復發性GBM患者的單一療法,使Optune自2007年以來成為中國首個獲批的膠質母細胞瘤療法。於2020年8月,Optune Lua TM 在香港推出用於治療MPM獲得Optune的獨家授權到在香港上市。
於2020年6月在中國推出Optune起,Optune獲列入省政府或市政府所指導的4種補充保險。
瑞派替尼為一種處於臨床開發階段的研究性KIT及PDGFRα激酶開關調控抑制劑,用於治療KIT及╱或PDGFRα驅動的癌症,包括GIST、係統性肥大細胞增多症(或SM)以及其他癌症。瑞派替尼特别設計用於通過抑制KIT及PDGFRα的廣譜突變來改善GIST患者的治療。
瑞派替尼為一種KIT及PDGFRα抑制劑,可阻斷GIST中涉及的第9、11、13、14、17及18外顯子中的初始及繼發性KIT突變以及SM中涉及的原發性D816V第17外顯子突變。瑞派替尼還抑制GIST的一個亞群中涉及的第12、14及18外顯子中的原發性PDGFRα突變,包括第18外顯子D842V突變。
再鼎於2019年6月自Deciphera獲得在中國、香港、澳門及中國台灣開發及商業化瑞派替尼的獨家授權。
總結
總體而言,相較於其他生物科技企業,再鼎佈局的產品(大部分來自授權)均臨近商業化階段,但由於潛在的市場空間並不確定,因此倘若未來商業化盈利難以匹配市值表現,其股價短期或有下跌的風險,投資者應當做好風險平衡。
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至content@finet.com.hk,獲得書面確認及授權後,方可轉載。
下載財華財經APP,把握投資先機
https://www.finet.com.cn/app
更多精彩内容,請點擊:
財華網(https://www.finet.hk/)
財華智庫網(https://www.finet.com.cn)
現代電視FINTV(https://www.fintv.hk)